Covid-ի համաճարակի ժամանակ ԱՄՆ կառավարությունը միլիարդավոր դոլարներ է ծախսել մոտ 400 ապրանքների վրա, որոնք նախատեսված են հարյուրավոր միլիոնավոր մարդկանց պաշտպանելու, ախտորոշելու և բուժելու համար՝ բոլորն էլ «EUA» կամ «Արտակարգ օգտագործման թույլտվություն» պիտակով:
Բայց ի՞նչ է իրականում նշանակում ԵՄԱ:
Նույնիսկ այդ հարցին պատասխանելուց առաջ, և հասկանալով, թե որտեղ է գտնվում EUA-ն բժշկական արտադրանքի թույլտվության կամ հաստատման այլ ուղիների հետ կապված, օգտակար է դիտարկել. այն, ինչ EUA-ն չէ:
EUA-ն նշանակում չէ կլինիկական փորձարկում անցնող փորձարարական արտադրանքի համար
Եթե մենք միայն մի բան հասկանանք EUA-ի մասին, ապա դա պետք է լինի հետևյալը. EUA-ն չի կիրառվում կլինիկական փորձարկում անցնող արտադրանքի նկատմամբ, որը կարգավորվում է FDA կանոնակարգերով կամ այլ իրավական պահանջներով:
EUA-ն նաև նույնը չէ, ինչ Expanded Access Use (EAU), որը հաճախ կոչվում է «կարեկցող օգտագործման» հասանելիություն, որը վերաբերում է ծանր, անբուժելի հիվանդություններով հիվանդներին փորձարարական արտադրանքներին հասանելիություն տրամադրելուն, նախքան դրանք լիովին հաստատվելը:
Այս աղյուսակը ան FDA-CDC 2020 ներկայացում ամփոփում է կլինիկական փորձարկումների ենթարկվող ապրանքների, ընդլայնված «կարեկցանքի» միջոցով հիվանդներին տրվող արտադրանքի և EUA-ի միջոցով լիազորված արտադրանքի միջև եղած տարբերությունները.
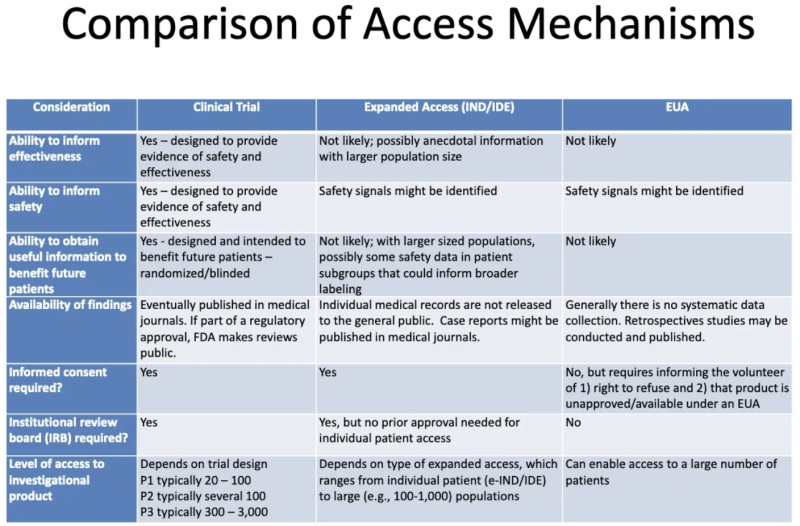
Ահա թե ինչ է մեզ ասում այս աղյուսակը EUA-ի մասին.
- EUA-ի տրամադրման գործընթացը, ամենայն հավանականությամբ, որևէ տեղեկատվություն չի առաջացնում արտադրանքի արդյունավետության մասին:
- EUA-ի տրամադրման գործընթացը նախատեսված չէ անվտանգության կամ արդյունավետության ապացույցներ ապահովելու համար, սակայն անվտանգության ազդանշանները կարող են նույնականացվել:
- Քիչ հավանական է, որ եթե արտադրանքը տրվի EUA-ին և այն տրամադրվի որոշ հիվանդների, որ որևէ օգտակար տեղեկատվություն ձեռք բերվի ապագա հիվանդների համար:
- EUA-ի հետ արդյունավետության կամ անվտանգության վերաբերյալ տվյալների համակարգված հավաքագրում չկա, և որևէ տվյալ չի հրապարակվում բժշկական ամսագրերում որպես կանոնակարգային հաստատման գործընթացի մաս:
- Ոչ մի տեղեկացված համաձայնություն չի պահանջվում, սակայն այն հիվանդներին, ովքեր «կամավոր են» ընդունել արտադրանքը, պետք է ասվի, որ կարող են հրաժարվել, և որ ապրանքը հաստատված չէ/հասանելի է EUA-ի ներքո:
- Ոչ մի ինստիտուցիոնալ վերանայման խորհուրդ (IRB) չի պահանջվում: [IRB խորհուրդ է, որը պետք է պաշտպանի մարդկային սուբյեկտների բարեկեցությունը կլինիկական փորձարկումներում]
Ավելի հստակեցնելու համար, թե որքանով է ԵՄԱ-ն առանձնացված ցանկացած նորմալ հաստատման գործընթացից, ա 2009 Ազգային ակադեմիաների բժշկության ինստիտուտի հրատարակություն, մենք գտնում ենք այս հայտարարությունը.
Կարևոր է գիտակցել, որ ԵՄԱ-ն զարգացման ուղու մաս չէ. այն ամբողջովին առանձին միավոր է, որն օգտագործվում է միայն արտակարգ իրավիճակների ժամանակ և դեղի հաստատման գործընթացի մաս չէ: (էջ 28)
Ամփոփելով:
Արտադրանքի EUA-ի տրամադրման գործընթացը դժվար թե ստեղծի անվտանգության կամ արդյունավետության որևէ ապացույց: Երբ արտադրանքը տրվում է EUA-ին և տրամադրվում է հիվանդներին, քիչ հավանական է, որ որևէ օգտակար տեղեկատվություն ձեռք բերվի ապագա հիվանդների համար, քանի որ չկա արդյունավետության կամ անվտանգության վերաբերյալ տվյալների համակարգված հավաքագրում:
Հիմնվելով CDC/FDA-ի և IMNA-ի այս բոլոր հստակ տեղեկատվության վրա՝ արդարացի կլինի եզրակացնել, որ Արտակարգ իրավիճակների օգտագործման թույլտվությունը գործընթաց է, որը պետք է կիրառվի շատ խելամիտ և միայն ծայրահեղ արտակարգ իրավիճակների դեպքում:
Այժմ եկեք տեսնենք, թե ինչ տեսակի արտակարգ իրավիճակներ է նախատեսված ԵՄԱ-ն լուծելու համար:
EAU-ն նախատեսված է WMD արտակարգ իրավիճակների համար
Վերը նկարագրված ԵՄԱ «Մուտքի մեխանիզմը» թույլատրող օրենքները մշակվել են զանգվածային ոչնչացման զենքի (WMD) հետ կապված ծայրահեղ, անհապաղ արտակարգ իրավիճակների դեպքերի համար, որոնք նաև կոչվում են CBRN (քիմիական, կենսաբանական, ճառագայթային, միջուկային) գործակալներ:
Ահա, թե ինչպես է Սննդի և Դեղերի վարչությունը (FDA) նկարագրում է իր EUA լիազորությունները:
FD&C Act-ի 564-րդ բաժին (21 USC 360bbb–3) թույլ է տալիս FDA-ին ուժեղացնել հանրային առողջության պաշտպանությունը կենսաբանական, քիմիական, միջուկային և ճառագայթային նյութերից:
EUA-ի այս լիազորությամբ FDA-ն կարող է օգնել ապահովելու, որ բժշկական հակաքայլերը կարող են օգտագործվել արտակարգ իրավիճակներում՝ ախտորոշելու, բուժելու կամ կանխելու լուրջ կամ կյանքին սպառնացող հիվանդությունները կամ պայմանները, որոնք առաջացել են կենսաբանական, քիմիական, միջուկային կամ ճառագայթային նյութերով, երբ չկան համապատասխան, հաստատված: և մատչելի այլընտրանքներ (ի թիվս այլ չափանիշների):
EUA-ի այս լիազորությունները տրվել են 2004թ.-ին շատ հատուկ հանգամանքներում՝ կապված CBRN գործակալների կողմից հարձակումների նախապատրաստության հետ:
Ինչպես բացատրվում է Հարվարդի իրավունքի Առողջության օրինագծում,
Ի վերջո, ահաբեկչության դեմ պատերազմն էր, որը կհանգեցներ արտակարգ իրավիճակների օգտագործման թույլտվության: 11 թվականի սեպտեմբերի 2001-ի իրադարձություններից և դրան հաջորդած սիբիրախտի փոստի հարձակումներից հետո Կոնգրեսը ընդունեց օրենքը. Project Bioshield Act 2004 թ.
The գրառում ցույց է տալիս, որ Կոնգրեսը կենտրոնացած էր հատկապես բիոահաբեկչության սպառնալիքի վրա, ոչ թե բնականորեն տեղի ունեցող համաճարակի պատրաստվելու վրա:
Հաշվի առնելով իսկապես ծայրահեղ արտակարգ իրավիճակների նման նեղ տեսակը, որը ներառում է WMD հարձակումը, հասկանալի է, թե ինչու EUA-ի «մուտքի մեխանիզմը» չի պահանջում մեծ կարգավորող վերահսկողություն կամ որևէ արտադրական կամ կլինիկական փորձարկման ստանդարտների պահպանում:
Այսպիսով, ի՞նչ է իրականում պահանջում ԵՄԱ մուտքի մեխանիզմը:
Արտակարգ իրավիճակների օգտագործման թույլտվության 3 քայլերը (EUA)
Երեք բան պետք է տեղի ունենա, որպեսզի EUA-ն տրվի բժշկական արտադրանքին.
- Ներքին անվտանգության քարտուղարը, պաշտպանության նախարարը կամ Առողջապահության և մարդկային ծառայությունների քարտուղարը պետք է որոշեն, որ կա արտակարգ իրավիճակ, որը ներառում է հարձակման կամ CBRN գործակալի հետ հարձակման սպառնալիք կամ նման գործակալի կողմից առաջացած հիվանդություն:
- FDA-ն պետք է համոզվի, որ այն համապատասխանում է չորս «կանոնադրական չափանիշներին», երբ թողարկում է EUA-ն:
- FDA-ն պետք է «պարտադրի որոշակի պահանջվող պայմաններ» ԵՄԱ-ում:
EUA Քայլ 1. ԿԲՌՆ արտակարգ իրավիճակի հայտարարում
ԵՄԱ-ի համար արտակարգ դրության հայտարարությունը առանձին է և կապ չունի որևէ այլ արտակարգ իրավիճակի հայտարարության հետ, որը կարող է տրվել Նախագահի, HHS քարտուղարի կամ որևէ մեկի կողմից: Այն պետք է տրվի հատուկ ԵՄԱ-ի ակտիվացման նպատակով և կարող է դադարեցվել կամ երկարաձգվել՝ անկախ որևէ այլ արտակարգ իրավիճակի հայտարարությունից:
Ահա ինչ է ԵՄԱ օրենքում ասվում է ԵՄԱ «մուտքի մեխանիզմի» ակտիվացման չորս հնարավոր սցենարներն են.
- Ներքին անվտանգության քարտուղարի որոշումը, որ կա ներքին արտակարգ իրավիճակ կամ ներքին արտակարգ իրավիճակի զգալի ներուժ, որը ներառում է կենսաբանական, քիմիական, ճառագայթային կամ միջուկային գործակալի կամ գործակալների հետ հարձակման բարձր ռիսկ.
- Պաշտպանության նախարարի որոշումն առ այն, որ կա ռազմական արտակարգ իրավիճակ կամ ռազմական արտակարգ իրավիճակի զգալի ներուժ, որը պարունակում է մեծ ռիսկ Միասնական States ռազմական ուժերը, ներառյալ անձնակազմը, որը գործում է վերնագրի 10-րդ կամ 50-րդ վերնագրի ներքո, հարձակման հետ.
- կենսաբանական, քիմիական, ճառագայթային կամ միջուկային նյութ կամ նյութեր. կամ
- գործակալ կամ գործակալներ, որոնք կարող են առաջացնել կամ այլ կերպ կապված լինել կյանքին անմիջականորեն սպառնացող և հատուկ վտանգ «Յունայթեդի» համար States ռազմական ուժեր;
- որոշմամբ քարտուղար [Առողջապահության և մարդկային ծառայությունների] մասին, որ առկա է հանրային առողջության արտակարգ իրավիճակ կամ հանրային առողջության արտակարգ իրավիճակի զգալի ներուժ, որն ազդում է կամ ազդելու զգալի ներուժ ունի ազգային անվտանգության կամ առողջության և անվտանգության վրա: Միասնական States արտասահմանում ապրող քաղաքացիներ, որոնք ներառում են կենսաբանական, քիմիական, ճառագայթային կամ միջուկային նյութ կամ նյութեր, կամ հիվանդություն կամ պայման, որը կարող է վերագրելի լինել այդպիսի գործակալին կամ գործակալներին. կամ
- նյութական սպառնալիքի նույնականացում՝ համաձայն 319F–2 բաժնի Հանրային առողջապահական ծառայության ակտ [42 USC 247d–6b] բավարար է ազգային անվտանգության կամ առողջության ու անվտանգության վրա ազդելու համար Միասնական States արտերկրում ապրող քաղաքացիները.
EUA Քայլ 2. Կանոնադրական չափանիշներին համապատասխանելը
Երբ քարտուղարներից մեկը հայտարարեց, որ կա արտակարգ իրավիճակ, որը երաշխավորում է EUA-ն, կան ևս չորս «կանոնադրական չափանիշներ», որոնք պետք է բավարարվեն, որպեսզի FDA-ն թողարկի EUA-ն: Ահա, թե ինչպես է FDA-ն բացատրում այս պահանջները:
- Լուրջ կամ կյանքին սպառնացող հիվանդություն կամ վիճակ
Որպեսզի FDA-ն թողարկի EUA, CBRN գործակալը (ներ)ը, որը նշված է HHS քարտուղարի EUA-ի հայտարարագրում, պետք է ի վիճակի լինի առաջացնել լուրջ կամ կյանքին սպառնացող հիվանդություն կամ պայման:
- Արդյունավետության ապացույց
Բժշկական արտադրանքները, որոնք կարող են դիտարկվել EUA-ի համար, այն են, որոնք «կարող են արդյունավետ լինել» կանխարգելելու, ախտորոշելու կամ բուժելու լուրջ կամ կյանքին սպառնացող հիվանդությունները կամ պայմանները, որոնք կարող են առաջանալ CBRN գործակալ(ներ)ի կողմից, որոնք նշված են HHS քարտուղարի հայտարարության մեջ: արտակարգ իրավիճակ կամ վտանգի վտանգ՝ համաձայն 564(բ) բաժնի։
EUA-ների «կարող է արդյունավետ լինել» ստանդարտը ապահովում է ապացույցների ավելի ցածր մակարդակ, քան «արդյունավետության» ստանդարտը, որն օգտագործում է FDA-ն արտադրանքի հաստատման համար: FDA-ն մտադիր է գնահատել հնարավոր EUA արտադրանքի պոտենցիալ արդյունավետությունը յուրաքանչյուր դեպքի հիման վրա՝ օգտագործելով ռիսկ-օգուտ վերլուծություն, ինչպես բացատրվում է ստորև:
[BOLDFACE ԱՎԵԼԱՑՎԱԾ]
- Ռիսկ-օգուտների վերլուծություն
Արտադրանքը կարող է դիտարկվել EUA-ի համար, եթե Հանձնակատարը որոշի, որ արտադրանքի հայտնի և հնարավոր օգուտները, երբ օգտագործվում են հայտնաբերված հիվանդությունը կամ վիճակը ախտորոշելու, կանխելու կամ բուժելու համար, գերազանցում են արտադրանքի հայտնի և հնարավոր ռիսկերը:
Որոշելով, թե արդյոք արտադրանքի հայտնի և հնարավոր օգուտները գերակշռում են հայտնի և հնարավոր ռիսկերին, FDA-ն մտադիր է նայել գիտական ապացույցների ամբողջության մեջ ռիսկ-օգուտ ընդհանուր որոշում կայացնելու համար: Այնպիսի ապացույցներ, որոնք կարող էր առաջանալ տարբեր աղբյուրներից, կարող է ներառել (բայց չի սահմանափակվում դրանով). ներքին և արտասահմանյան կլինիկական փորձարկումների արդյունքներ, in vivo արդյունավետության տվյալներ կենդանիների մոդելներից և in vitro տվյալներ, հասանելի է FDA-ի դիտարկման համար. FDA-ն նաև կգնահատի արտադրանքի որակն ու քանակը առկա ապացույցներ, հաշվի առնելով գիտական գիտելիքների ներկա վիճակը։
[BOLDFACE ԱՎԵԼԱՑՎԱԾ]
- Այլընտրանք չկա
Որպեսզի FDA-ն թողարկի EUA, չպետք է լինի համապատասխան, հաստատված և հասանելի այլընտրանք թեկնածու արտադրանքին հիվանդության կամ վիճակի ախտորոշման, կանխարգելման կամ բուժման համար: Պոտենցիալ այլընտրանքային արտադրանքը կարող է համարվել «անհասանելի», եթե հաստատված այլընտրանքի բավարար պաշարներ չկան՝ արտակարգ իրավիճակները լիովին բավարարելու համար:
EUA Քայլ 3. Պահանջվող պայմանների սահմանում
Երբ մենք ունենանք ԵՄԱ-ի հատուկ արտակարգ իրավիճակների հայտարարությունը, և երբ FDA-ն որոշի, որ արտադրանքը կարող է արդյունավետ լինել, և որ առկա ապացույցները ցույց են տալիս, որ դրա օգուտները գերազանցում են ռիսկերը, գոյություն ունի հարակից կարգավորման ևս մեկ շերտ:
Ահա թե ինչպես ա 2018 Կոնգրեսի հետազոտական ծառայության զեկույց ԵՄԱ-ի վերաբերյալ բացատրում է սա.
FFDCA §564-ը հրահանգում է FDA-ին սահմանել որոշակի պահանջվող պայմաններ EUA-ում և թույլատրում է լրացուցիչ հայեցողական պայմաններ, որտեղ անհրաժեշտ է: Պահանջվող պայմանները տարբերվում են՝ կախված այն բանից, թե արդյոք EUA-ն նախատեսված է չհաստատված արտադրանքի համար, թե հաստատված արտադրանքի չհաստատված օգտագործման համար: Չհաստատված արտադրանքի համար օգտագործման պայմանները պետք է.
(1) ապահովել, որ արտադրանքը տնօրինող առողջապահական մասնագետները ստանան անհրաժեշտ տեղեկատվություն.
(2) ապահովել, որ անհատները, որոնց տրամադրվում է արտադրանքը, ստանան պահանջվող տեղեկատվությունը.
3) ապահովում է արտադրանքի հետ կապված անբարենպաստ իրադարձությունների մոնիտորինգ և հաղորդում. և
4) նախատեսում է արտադրողի կողմից գրանցումների պահպանում և հաշվետվություններ:
Եզրափակում
Ինչպես նշված է այս հոդվածում, FDA/CDC-ն հստակ գիտակցում է, որ Արտակարգ իրավիճակների օգտագործման թույլտվություն (EUA) տրամադրելու գործընթացը դժվար թե որևէ տեղեկատվություն ստեղծի արտադրանքի արդյունավետության կամ անվտանգության մասին: Երբ նայում ենք ԵՄԱ կարգավորող օրենքի տառին, տեսնում ենք, որ դա, իրոք, ճիշտ գնահատական է։
EUA օրենքը չի պարտադրում որևէ իրավական կամ կարգավորող ստանդարտ, որը կարող է որոշել արտադրանքի անվտանգ կամ արդյունավետ լինելը: Միակ ստանդարտներն այն են, թե արդյոք FDA-ն կարծում է, որ արտադրանքը կարող է արդյունավետ լինել, և որ դրա հայտնի օգուտները գերակշռում են հայտնի վնասներին: Եթե չկան հայտնի վնասներ կամ հայտնի օգուտներ, քանի որ արտադրանքը երբեք չի անցել դեղերի հաստատման գործընթաց, FDA-ն կարող է օգտագործել ցանկացած տեղեկատվություն կամ ստանդարտներ, որոնք նա կընտրի այդ որոշումը կայացնելու համար:
Այս ամենից հետևում է, որ ընկերությունը, որի արտադրանքը հանդիսանում է EUA-ի թեկնածու, կարող է փորձել ցույց տալ արտադրանքի անվտանգությունը և/կամ արդյունավետությունը իր ընտրած միջոցներով: Նման փորձի առկայությունը (լինի կլինիկական փորձարկում, թե տվյալների հավաքագրման այլ մեխանիզմ), և թե ինչպես է այդ փորձն իրականացվել, բոլորը կախված են ընկերությանից: EUA-ի օրենքում ոչինչ չի կիրառվում այն մասին, թե ինչպես է ընկերությունը նախագծում, իրականացնում կամ վերլուծում որևէ ուսումնասիրություն կամ տվյալների հավաքագրման այլ մեխանիզմներ, որոնք նա ընտրում է:
Կիրառվում է Covid արտադրանքի համար, սա նշանակում է.
- Կլինիկական փորձարկումներից անվտանգության կամ արդյունավետության տվյալներ չեն պահանջվել, որպեսզի Covid-ի արտադրանքը ստանա EUA:
- ԵՄԱ գործընթացում նշված ցանկացած կլինիկական փորձարկումներ իրականացվել են առանց իրավականորեն կիրառելի կարգավորող ստանդարտների:
- Երբ մենք պարզում ենք, որ այս արտադրանքը չունի արդյունավետություն կամ անվտանգություն, դա զարմանալի չէ: Դա գործընթացի շատ հավանական արդյունք է:
- EUA-ի գործընթացից չկան տվյալներ, որոնց վրա կարելի է հիմնել արտադրանքի անվտանգության կամ արդյունավետության վերաբերյալ ոչ ԵՄ-ի որոշումները: Այսպիսով, արտադրանքի ոչ ԵՄ-ից դուրս ցանկացած օգտագործումը կպահանջի ի սկզբանե անցնել սովորական բժշկական արտադրանքի օրինական հաստատման գործընթաց:
Ավելին՝ Covid-ի դեմ պատվաստանյութերի հաստատման գործընթացի մասին այստեղ.
Վերահրատարակվել է հեղինակայինից Ենթարկ
Հրատարակված է Ա Creative Commons Attribution 4.0 միջազգային լիցենզիա
Վերատպումների համար խնդրում ենք կանոնական հղումը վերադարձնել բնօրինակին Բրաունսթոունի ինստիտուտ Հոդված և հեղինակ.









