In այս հոդվածի առաջին մասը, ես վերանայեցի ԱՄՆ կառավարության կողմից կիրառված պայմանագրային և կարգավորող շրջանակը Covid mRNA նկարահանումների սկզբնական մշակման, արտադրության և ձեռքբերման համար՝ օգտագործելով BioNTech/Pfizer համաձայնագրերը՝ գործընթացը լուսաբանելու համար:
Ես ցույց տվեցի, որ Արտակարգ իրավիճակների օգտագործման թույլտվությունը (EUA) տրվել է այս ապրանքներին՝ հիմնվելով կլինիկական փորձարկումների և արտադրական գործընթացների վրա, որոնք իրականացվել են
- ոչ պարտադիր իրավական ստանդարտներ,
- ոչ մի օրենսդրորեն արգելված անվտանգության վերահսկողություն կամ կարգավորում, և
- ոչ մի իրավական փոխհատուցում արտադրողի կողմից հնարավոր վնասների համար:
Այս հաջորդ հոդվածում ես կներկայացնեմ հիմքում ընկած փաստաթղթերի մանրամասն վերլուծությունը:
Գործարքների այլ մարմին/համաձայնագիր (OTA). Ռազմական ձեռքբերման ուղի
The համաձայնագիր ԱՄՆ կառավարության՝ ի դեմս Պաշտպանության նախարարության (DoD) և Pfizer-ի, որը ներկայացնում է BioNTech/Pfizer համագործակցությունը, 2020 թվականի հուլիսին «COVID-19-ի կանխարգելման պատվաստանյութի» գնումը սովորական գնման պայմանագիր չէր:
Դա այլ գործարքների մարմնի (OTA) ներքո կնքված համաձայնագիր էր. ձեռքբերման ուղի, որը, ըստ Պաշտպանության նախարարության ուղեցույցները, օգտագործվում է 1958 թվականից՝ «դաշնային գործակալությանը մուտք գործելու թույլտվություն տալու համար գործարքներ, բացի պայմանագրերից, դրամաշնորհներից կամ համագործակցության պայմանագրերից».
[BOLDFACE ԱՎԵԼԱՑՎԱԾ]
DoD-ի կողմից OTA-ի օգտագործման մանրակրկիտ վերանայում, ներառյալ դրա կանոնադրական պատմությունը, կարելի է գտնել Փետրվարի 22, 2019 Կոնգրեսի հետազոտական ծառայության զեկույց. Այս զեկույցը, OTA-ի ցանկացած այլ քննարկման հետ մեկտեղ, նշում է, որ դա ձեռքբերման այլընտրանքային ճանապարհ է պաշտպանական և ռազմական նպատակներով. Այն նախատեսված չէ, ոչ էլ երբևէ օգտագործվել է մինչև Covid-ը, որևէ բանի համար, որը նախատեսված է հիմնականում քաղաքացիական օգտագործման համար:
Եթե դուք փնտրում եք OTA օրենքները ԱՄՆ օրենսգրքում, սա այն ճանապարհն է, որով դուք կգնաք.
Զինված ուժեր -> Ընդհանուր ռազմական իրավունք -> Ձեռքբերում -> Հետազոտություն և ճարտարագիտություն -> Պայմանագրեր -> Նախատիպային նախագծեր իրականացնելու նախարարության լիազորություն
Այս իրավական ճանապարհը շատ հստակ ցույց է տալիս, որ OTA օրենքները նախատեսված են զինված ուժերի համար հետազոտական և ինժեներական նախատիպեր ձեռք բերելու համար:
Պաշտպանության նախարարությունը իրավասու է երեք տարբեր տեսակի ՕՀ-ների համար.
Այս երեք տեսակի OT-ները ներկայացնում են նախնական հետազոտության, նախատիպի մշակման և վերջնական արտադրության երեք փուլ:
Այդ երեք տեսակի շրջանակներում կան նախագծերի հատուկ կատեգորիաներ, որոնց OTA-ն կարող է դիմել.
- Ի սկզբանե, ըստ OTA ակնարկ DoD-ի կողմից տրամադրված գործարքների մյուս մարմինը «սահմանափակված էր կիրառելու զենքի կամ զենքի համակարգերի նկատմամբ, որոնք առաջարկվում էին ձեռք բերել կամ մշակել DoD-ի կողմից»:
- OTA-ն ավելի ուշ ընդլայնվեց՝ ներառելով «ցանկացած նախատիպ նախագիծ, որն ուղղակիորեն կապված է ռազմական անձնակազմի և օժանդակ հարթակների, համակարգերի, բաղադրիչների կամ նյութերի բարձրացման հետ, որոնք առաջարկվում են ձեռք բերել կամ մշակել DoD-ի կողմից, կամ հարթակներ, համակարգեր, բաղադրիչներ կատարելագործել»: , կամ զինված ուժերի կողմից կիրառվող նյութեր»։
Առայժմ դրանցից ոչ մեկը չի հնչում որպես միլիոնավոր նոր բժշկական արտադրանքի ձեռքբերման ուղի, որոնք հիմնականում նախատեսված են քաղաքացիական օգտագործման համար:
Կա՞ որևէ բացառություն OTA-ի քաղաքացիական օգտագործման համար, որը կարող է վերաբերել Covid mRNA պատվաստանյութերին:
The FY2004 Ազգային պաշտպանության լիազորման ակտ (P.L. 108-136) պարունակում էր մի բաժին, որը տալիս էր այլ գործարքների լիազորություն «գործադիր մարմնի ղեկավարին, որը զբաղվում է հիմնարար հետազոտություններով, կիրառական հետազոտություններով, առաջադեմ հետազոտություններով և զարգացման ծրագրերով», որոնք «ներուժ ունեն աջակցելու ահաբեկչությունից կամ վերականգնումից, միջուկային, կենսաբանական, քիմիական կամ ճառագայթային հարձակում»:
Այս դրույթը երկարաձգվել է մինչև 2018 թվականը, սակայն, ըստ երևույթին, չի երկարացվել այդ տարվանից հետո: Նկատի ունեցեք նաև, որ նույնիսկ այս բացառիկ դեպքում OTA-ի ոչ DoD օգտագործման դեպքում, Իրավիճակը պետք է ներառի ահաբեկչություն կամ հարձակում զանգվածային ոչնչացման զենքով (CBRN).
Ի՞նչ այլ OTA օրենքներ կարող են կիրառվել:
Վերևում մեջբերված 2019 թվականի CRS զեկույցը ներկայացնում է այս աղյուսակը՝ ցույց տալով, որ մի քանի ոչ DoD գործակալություններ ունեն որոշ OTA կամ հարակից լիազորություններ.
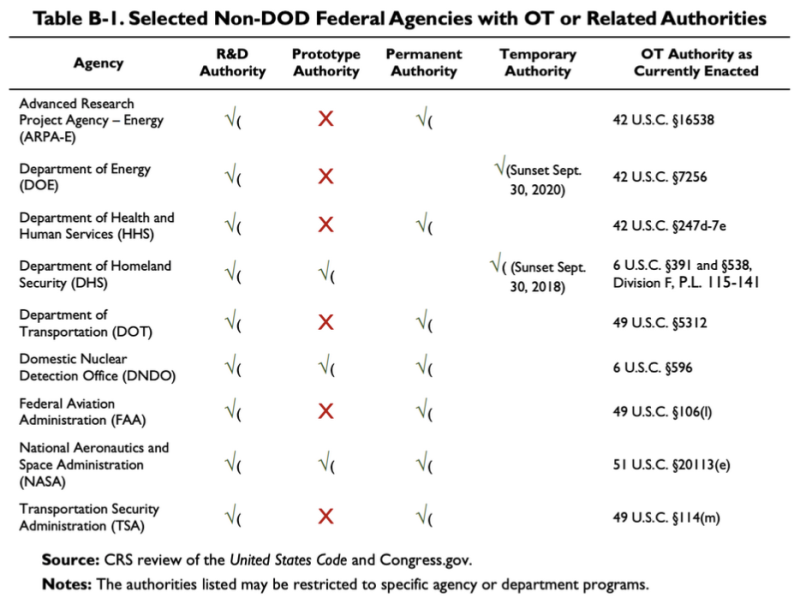
Համաձայն այս աղյուսակի՝ Առողջապահության և մարդկային ծառայությունների դեպարտամենտը (HHS) ունի որոշ հետազոտությունների և զարգացման (R&D) Գործարքների այլ մարմիններ: -ին վերաբերող օրենքը HHS-ի OT իշխանությունը 42 U.S.C. §247d-7e.
Որտե՞ղ է դրված այս օրենքը և ի՞նչ է այն ասում:
Հանրային առողջապահություն և բարեկեցություն -> Հանրային առողջապահական ծառայություն -> Ընդհանուր լիազորություններ և պարտականություններ -> դաշնային-պետական համագործակցություն -> Կենսաբժշկական առաջադեմ հետազոտությունների և զարգացման մարմին (BARDA) -> Գործարքի մարմիններ
Այսպիսով, օրենքում կա մի տեղ, որը վերաբերում է քաղաքացիական անձանց առողջությանը և բարեկեցությանը, որտեղ OTA-ն կարող է կիրառվել, թեև այն վավեր է: միայն հետազոտության և զարգացման համար, այլ ոչ թե նախատիպերի կամ արտադրության համար:
Օրենքում ասվում է, որ BARDA-ի քարտուղարն ունի OT լիազորություն
ապրանքի նկատմամբ, որը կամ կարող է դառնալ ա որակավորված հակաքայլ կամ որակավորված համաճարակային կամ համաճարակային արտադրանքգործողություններ, որոնք հիմնականում՝
(i) իրականացվում են արտադրանքի հիմնական հետազոտությունից և նախակլինիկական մշակումից հետո. և
(ii) կապված են ապրանքի արտադրության առևտրային մասշտաբով և ձևով, որը բավարարում է Դաշնային կարգավորող պահանջներին Սննդի, դեղերի և կոսմետիկայի ակտ [21 USC 301 et seq.] կամ տակ սույն վերնագրի 262-րդ բաժինը.
[BOLDFACE ԱՎԵԼԱՑՎԱԾ]
Օրենքում թվարկված «կարգավորիչ պահանջները» նշանակում են, որ BARDA/HHS-ի համար անհնար կլինի համաձայնագրեր կնքել, նույնիսկ միայն R&D, ցանկացած բժշկական արտադրանքի համար (ինչպես mRNA պատվաստանյութերը), որոնք չեն ենթարկվել անվտանգության խիստ փորձարկումների և արտադրության խիստ վերահսկողության:
HHS «Գործընկերություն» DoD-ի հետ շրջանցված քաղաքացիական պաշտպանության օրենքները
Ամփոփելու համար Գործարքների այլ մարմնի/համաձայնագրերի անախորժությունը քաղաքացիական իշխանությունների, ընդհանուր առմամբ, և Covid mRNA պատվաստանյութերի հետ կապված, մասնավորապես.
- OTA-ն գրվել և ծածկագրվել է որպես զինվորականների համար զենք և այլ անհրաժեշտ համակարգեր և սարքավորումներ ձեռք բերելու միջոց՝ առանց բյուրոկրատական մեծ ժանրերի: Այն ընդգրկում է հետազոտությունն ու մշակումը, նախատիպերը և հետագա արտադրությունը:
- Հանրային առողջապահական գործակալության միակ OTA-ն նախատեսված է HHS-ի համար և այն ընդգրկում է միայն հետազոտություն և զարգացում, այլ ոչ թե նախատիպերը կամ արտադրությունը:
- Նույնիսկ HHS-ին տրված R&D OTA-ն դեռ պահանջում է արտադրանքի արտադրություն «այն ձևով, որը բավարարում է դեղերի և պատվաստանյութերի անվտանգության կանոնակարգման պահանջները»:
Այլ կերպ ասած, ոչ մի կերպ HHS-ն կարող էր օգտագործել իր խիստ սահմանափակ OTA-ն հարյուր միլիոնավոր նոր բժշկական արտադրանքի համար պայմանագրեր կնքելու համար:
Այսպիսով, ի՞նչ արեց HHS-ը:
Ինչպես իր մեջ նշել է Կառավարության հաշվետվողականության գրասենյակը (GAO). 2021 թվականի հուլիս զեկույց «Covid-19 Contracting». HHS-ը «գործակցել է» DoD-ի հետ՝ «օգտագործելու DoD-ի OTA իշխանությունները…որը բացակայում էր HHS-ին»: (p. 24)
Որո՞նք են DoD-ի OT մարմինները բժշկական արտադրանքների համար:
Ինչպես քննարկվեց, OTA-ն կոչված է օգնելու զինվորականներին ձեռք բերել սարքավորումներ և տեխնոլոգիաներ՝ առանց բյուրոկրատական մեծ դժվարությունների: OTA-ին վերաբերող բնօրինակ օրենքներից ոչ մեկը չի նշել որևէ այլ բան, քան «հարթակներ, համակարգեր, բաղադրիչներ կամ նյութեր», որոնք նախատեսված են «զինվորական անձնակազմի առաքելության արդյունավետությունը բարձրացնելու համար»:
Բայց Covid-ից հինգ տարի առաջ ներդրվեց OTA-ի բացառիկ օգտագործումը.
Ի 2015, DoD-ն հայտարարեց CBRN Medical Countermeasure Consortium-ի ստեղծումը, որի նպատակն էր օգտագործել OTA-ի ձեռքբերման ուղին «DoD-ի հետ աշխատելու համար՝ մշակելու FDA լիցենզավորված քիմիական, կենսաբանական, ճառագայթային և միջուկային բժշկական հակաքայլեր»: [FDA = Սննդի և դեղերի վարչություն]
Ինչպես նկարագրված է 2015 թվականի հայտարարության մեջ, սա ներառում էր «նախատիպային տեխնոլոգիաներ թերապևտիկ բժշկական հակաքայլերի համար, որոնք ուղղված են ԴՆ-ին հետաքրքրող վիրուսային, բակտերիալ և կենսաբանական թունավոր թիրախներին»: Գործակալների ցանկը ներառում էր բիոպատերազմի հիմնական պաթոգենները, ինչպիսիք են սիբիրախտը, էբոլան և մարբուրգը:
Հայտարարությունը շարունակեց հստակեցնել, որ «հնարավոր տեխնոլոգիաները կարող են ներառել վիրուսային, բակտերիալ կամ կենսաբանական տոքսինների հիվանդության և պաթոգենեզի կենդանիների մոդելներ (ազդեցության բազմաթիվ ուղիներ), փորձարկումներ, ախտորոշիչ տեխնոլոգիաներ կամ այլ հարթակի տեխնոլոգիաներ, որոնք կարող են կիրառվել հաստատված կամ լիցենզավորված MCM-ների մշակման համար։ [բժշկական հակաքայլեր]»:
Թեև սա դեռևս նման չէ քաղաքացիական օգտագործման համար 100 միլիոն նոր պատվաստանյութերի արտադրությանը, այն ավելի մեծ ազատություն է տալիս OTA-ին, քան HHS-ին տրված այլ գործարքների շատ սահմանափակ մարմինը:
Թեև HHS OTA-ն պահանջում է հետևել լայնածավալ զարգացման և արտադրության կանոնակարգերին, DoD-ի համար բժշկական հակաքայլեր մշակելու OTA ուղին պահանջում է միայն «FDA լիցենզիա»:
Այսպիսով, օգտագործելով DoD Այլ գործարքների մարմինները, տեսականորեն հնարավոր կլինի շրջանցել անվտանգության ցանկացած կանոն՝ կախված OTA-ի կողմից ստեղծված արտադրանքի FDA լիցենզավորման պահանջներից: Ինչպես կտեսնենք, Covid-ի mRNA պատվաստանյութերի դեպքում տրվել է Արտակարգ իրավիճակների օգտագործման թույլտվություն, որն ընդհանրապես չի պահանջում անվտանգության իրավական վերահսկողություն:
Արտակարգ իրավիճակների օգտագործման թույլտվություն (EUA)
Ահա, թե ինչպես է Սննդի և Դեղերի վարչությունը (FDA) նկարագրում է իր EUA լիազորությունները:
FD&C Act-ի 564-րդ բաժին (21 USC 360bbb–3) թույլ է տալիս FDA-ին ուժեղացնել հանրային առողջության պաշտպանությունը կենսաբանական, քիմիական, միջուկային և ճառագայթային նյութերից:
EUA-ի այս լիազորությամբ FDA-ն կարող է օգնել ապահովելու, որ բժշկական հակաքայլերը կարող են օգտագործվել արտակարգ իրավիճակներում՝ ախտորոշելու, բուժելու կամ կանխելու լուրջ կամ կյանքին սպառնացող հիվանդությունները կամ պայմանները, որոնք առաջացել են կենսաբանական, քիմիական, միջուկային կամ ճառագայթային նյութերով, երբ չկան համապատասխան, հաստատված: և մատչելի այլընտրանքներ (ի թիվս այլ չափանիշների):
Չափազանց կարևոր է հասկանալ, որ ԵՄԱ-ի այս լիազորությունները տրվել են 2004 թվականին շատ հատուկ հանգամանքներում՝ կապված զանգվածային ոչնչացման զենքերի հարձակումների պատրաստության հետ, այլապես հայտնի են որպես CBRN (քիմիական, կենսաբանական, ճառագայթային, միջուկային) գործակալներ:
Ինչպես բացատրվում է Հարվարդի իրավունքի Առողջության օրինագծում,
Ի վերջո, ահաբեկչության դեմ պատերազմն էր, որը կհանգեցներ արտակարգ իրավիճակների օգտագործման թույլտվության: 11 թվականի սեպտեմբերի 2001-ի իրադարձություններից և դրան հաջորդած սիբիրախտի փոստի հարձակումներից հետո Կոնգրեսը ընդունեց օրենքը. Project Bioshield Act 2004 թ. Ակտը պահանջում էր միլիարդավոր դոլարների հատկացումներ պատվաստանյութեր ձեռք բերելու համար՝ նախապատրաստվելու համար կենսաահաբեկչական հարձակմանը և արտակարգ իրավիճակների հակազդման միջոցներ կուտակելու համար: Արտակարգ իրավիճակներում արագ գործելու համար Կոնգրեսը թույլատրեց FDA-ին թույլատրել պաշտոնապես չհաստատված արտադրանքները արտակարգ իրավիճակներում օգտագործելու համար՝ ընդդեմ հանրային առողջության և անվտանգության սպառնալիքի (ենթակա է HHS-ի կողմից արտակարգ դրության հայտարարման): Այն գրառում ցույց է տալիս, որ Կոնգրեսը կենտրոնացած էր հատկապես բիոահաբեկչության սպառնալիքի վրա, ոչ թե բնականորեն տեղի ունեցող համաճարակի պատրաստվելու վրա:
The ԵՄԱ օրենքի ձևակերպումը ընդգծում է այն փաստը, որ այն նախատեսված էր զանգվածային ոչնչացման զենքի հետ կապված իրավիճակներում օգտագործելու համար։ Ահա 4 իրավիճակները, որոնց դեպքում ԵՄԱ կարող է տրվել.
- Ներքին անվտանգության քարտուղարի որոշումը, որ կա ներքին արտակարգ իրավիճակ կամ ներքին արտակարգ իրավիճակի զգալի ներուժ, որը ներառում է կենսաբանական, քիմիական, ճառագայթային կամ միջուկային գործակալի կամ գործակալների հետ հարձակման բարձր ռիսկ.
- Պաշտպանության նախարարի որոշումը, որ կա ռազմական արտակարգ իրավիճակ կամ ռազմական արտակարգ իրավիճակի զգալի ներուժ, որը մեծ վտանգ է պարունակում Միացյալ Նահանգների համար. States ռազմական ուժերը, ներառյալ անձնակազմը, որը գործում է վերնագրի 10-րդ կամ 50-րդ վերնագրի ներքո, հարձակման հետ.
- կենսաբանական, քիմիական, ճառագայթային կամ միջուկային նյութ կամ նյութեր. կամ
- գործակալ կամ գործակալներ, որոնք կարող են առաջացնել կամ այլ կերպ կապված լինել կյանքին անմիջականորեն սպառնացող և հատուկ վտանգ «Յունայթեդի» համար States ռազմական ուժեր;
- որոշմամբ քարտուղար որ կա հանրային առողջության արտակարգ իրավիճակ կամ հանրային առողջության արտակարգ իրավիճակի զգալի ներուժ, որն ազդում է կամ ունի ազդելու զգալի ներուժ ազգային անվտանգության կամ Միացյալ Նահանգների առողջության և անվտանգության վրա States արտասահմանում ապրող քաղաքացիներ, որոնք ներառում են կենսաբանական, քիմիական, ճառագայթային կամ միջուկային նյութ կամ նյութեր, կամ հիվանդություն կամ պայման, որը կարող է վերագրելի լինել այդպիսի գործակալին կամ գործակալներին. կամ
- նյութական սպառնալիքի նույնականացում՝ համաձայն 319F–2 բաժնի Հանրային առողջապահական ծառայության ակտ [42 USC 247d–6b] բավարար է ազգային անվտանգության կամ United-ի առողջության և անվտանգության վրա ազդելու համար States արտերկրում ապրող քաղաքացիները.
Այս չորս իրավիճակներում ոչ մի տեղ չի հիշատակվում բնական համաճարակի, համաճարակի կամ հանրային առողջության որևէ այլ տեսակի իրավիճակի մասին, որը պայմանավորված չէ «կենսաբանական, քիմիական, ճառագայթային կամ միջուկային գործակալներով»:
Կարո՞ղ է SARS-CoV-2-ը որակավորվել որպես այդպիսի գործակալ:
Եթե դուք փնտրում եք սահմանումը «կենսաբանական նյութերԱՄՆ Իրավական օրենսգրքում դուք կանցնեք հետևյալ ճանապարհով.
Հանցագործություններ և քրեական դատավարություն -> Հանցագործություններ -> Կենսաբանական զենքեր -> Սահմանումներ
Այսպիսով, Միացյալ Նահանգների օրենսդրության համատեքստում «կենսաբանական գործակալներ» տերմինը նշանակում է կենսաբանական զենք, և նման գործակալների/զենքերի օգտագործումը համարվում է հանցագործություն:
Վիքիպեդիան դա ապահովում է սահմանում:
Կենսաբանական գործակալը (նաև կոչվում է կենսագործակալ, կենսաբանական սպառնալիք, կենսաբանական պատերազմի գործակալ, կենսաբանական զենք կամ կենսազենք) միկրոբ, վիրուս, պրոտոզո, ձրիակեր, բորբոսկամ թույն, որը կարող է նպատակային կերպով օգտագործվել որպես զենք բիոտերրորիզմ or կենսաբանական պատերազմ (BW):
Ի՞նչ իրավական հիմքի վրա է թողարկվել ԵՄԱ-ն Covid mRNA պատվաստանյութերի համար:
Թվում է, թե EUA-ի վերաբերյալ օրենքներից ելնելով, օրենքում նկարագրված չորս հնարավոր իրավիճակներից և ոչ մեկը չի կարող կիրառվել արտադրանքի նկատմամբ, որը նախատեսված է կանխարգելելու կամ բուժելու հիվանդությունը, որն առաջանում է բնական պաթոգենից:
Այնուամենայնիվ, այս օրենքը օգտագործվել է mRNA Covid պատվաստանյութերը թույլատրելու համար:
Հաշվի առնելով ԵՄԱ օրենքում թվարկված չորս ընտրությունը՝ այն, որն օգտագործվել է Covid-ի «հակամիջոցների» համար.
Գ) որոշումը քարտուղար որ կա հանրային առողջության արտակարգ իրավիճակ կամ հանրային առողջության արտակարգ իրավիճակի զգալի ներուժ, որն ազդում է կամ ունի ազդելու զգալի ներուժ ազգային անվտանգության կամ Միացյալ Նահանգների առողջության և անվտանգության վրա States արտերկրում ապրող քաղաքացիներ, և դա ներառում է կենսաբանական, քիմիական, ճառագայթային կամ միջուկային նյութ կամ նյութեր, կամ հիվանդություն կամ պայման, որը կարող է վերագրելի լինել այդպիսի գործակալին կամ գործակալներին:
Երբ կիրառվել է հատուկ Covid-ի համար, այսպես է ձևակերպվել.
Առողջապահության և մարդկային ծառայությունների դեպարտամենտի (HHS) քարտուղարը որոշել է, որ կա հանրային առողջապահական արտակարգ իրավիճակ, որը զգալի ներուժ ունի ազդելու ազգային անվտանգության կամ արտերկրում ապրող Միացյալ Նահանգների քաղաքացիների առողջության և անվտանգության վրա, և որը ներառում է կորոնավիրուսը առաջացնող վիրուսը։ Հիվանդություն 2019 (COVID-19)…
Այստեղ կասկած չկա, որ «COVID-19-ի պատճառած վիրուսը» համարվում է «կենսաբանական, քիմիական, ճառագայթային կամ միջուկային գործակալի կամ գործակալների» համարժեքը։
Կարևոր է նաև նշել, որ ԵՄԱ-ի «հանրային առողջապահական արտակարգ իրավիճակի որոշումը» լիովին անջատված է և ոչ մի կերպ չի հիմնվում հանրային առողջության որևէ այլ արտակարգ իրավիճակների հայտարարություններից, ինչպիսիք են ԱՀԿ-ի, ԱՄՆ կառավարության կողմից արված հայտարարությունները: , և Նախագահը՝ Covid-19 համաճարակի սկզբում։
Այսպիսով, նույնիսկ այն ժամանակ, երբ ԱՀԿ-ն, ԱՄՆ կառավարությունը և նախագահը հայտարարեն, որ համաճարակն ավարտված է, դեռ կարող է լինել Արտակարգ իրավիճակների օգտագործման թույլտվություն, եթե HHS քարտուղարը շարունակի պնդել, որ գոյություն ունի C բաժնում նկարագրված իրավիճակը:
Նայում բոլոր EUA-ները հարյուրավոր Covid-ի հետ կապված բժշկական արտադրանքների համար, շատ դժվար է տեսնել, թե ինչպես է HHS քարտուղարը կարող է հիմնավորել այն պնդումը, որ «կա հանրային առողջության արտակարգ իրավիճակ, որը զգալի ներուժ ունի ազդելու ազգային անվտանգության կամ արտերկրում ապրող ԱՄՆ քաղաքացիների առողջության և անվտանգության վրա» մեծ մասում, եթե ոչ բոլորում, այս դեպքերից։
Լրացուցիչ «կանոնադրական չափանիշներ» FDA-ի համար՝ Արտակարգ իրավիճակներում օգտագործման թույլտվություն տրամադրելու համար
Երբ HHS քարտուղարը հայտարարում է, որ կա հանրային առողջության արտակարգ իրավիճակ, որը երաշխավորում է EUA-ն, հիմնվելով օրենքում թվարկված չորս իրավիճակներից մեկի վրա, կան ևս չորս «կանոնադրական չափանիշներ», որոնք պետք է բավարարվեն, որպեսզի FDA-ն թողարկի EUA: . Ահա, թե ինչպես է FDA-ն բացատրում այս պահանջները:
- Լուրջ կամ կյանքին սպառնացող հիվանդություն կամ վիճակ
Որպեսզի FDA-ն թողարկի EUA, CBRN գործակալը (ներ)ը, որը նշված է HHS քարտուղարի EUA-ի հայտարարագրում, պետք է ի վիճակի լինի առաջացնել լուրջ կամ կյանքին սպառնացող հիվանդություն կամ պայման:
ԾԱՆՈԹՈՒԹՅՈՒՆ. Այս չափանիշը կրկնում է CBRN գործակալի բնութագրումը, որն իրավաբանորեն սահմանվում է որպես հանցագործություն կատարելու համար օգտագործվող զենք:
- Արդյունավետության ապացույց
Բժշկական արտադրանքները, որոնք կարող են դիտարկվել EUA-ի համար, այն են, որոնք «կարող են արդյունավետ լինել» կանխարգելելու, ախտորոշելու կամ բուժելու լուրջ կամ կյանքին սպառնացող հիվանդությունները կամ պայմանները, որոնք կարող են առաջանալ CBRN գործակալ(ներ)ի կողմից, որոնք նշված են HHS քարտուղարի հայտարարության մեջ: արտակարգ իրավիճակ կամ վտանգի վտանգ՝ համաձայն 564(բ) բաժնի։
EUA-ների «կարող է արդյունավետ լինել» ստանդարտը ապահովում է ապացույցների ավելի ցածր մակարդակ, քան «արդյունավետության» ստանդարտը, որն օգտագործում է FDA-ն արտադրանքի հաստատման համար: FDA-ն մտադիր է գնահատել հնարավոր EUA արտադրանքի պոտենցիալ արդյունավետությունը յուրաքանչյուր դեպքի հիման վրա՝ օգտագործելով ռիսկ-օգուտ վերլուծություն, ինչպես բացատրվում է ստորև:
[BOLDFACE ԱՎԵԼԱՑՎԱԾ]
ԻՐԱՎԱԿԱՆ ՀԱՐՑ. Ինչպե՞ս կարող է որևէ մեկը իրավաբանորեն պնդել, որ EUA-ի ներքո լիազորված արտադրանքը «անվտանգ և արդյունավետ է», եթե EUA-ի իրավական ստանդարտը «կարող է արդյունավետ լինել», և FDA-ն հայտարարում է, որ սա «ապացույցների ցածր մակարդակ» է, քան օգտագործված ստանդարտը: կանոնավոր արտադրանքի հաստատման համար:
- Ռիսկ-օգուտների վերլուծություն
Արտադրանքը կարող է դիտարկվել EUA-ի համար, եթե Հանձնակատարը որոշի, որ արտադրանքի հայտնի և հնարավոր օգուտները, երբ օգտագործվում են հայտնաբերված հիվանդությունը կամ վիճակը ախտորոշելու, կանխելու կամ բուժելու համար, գերազանցում են արտադրանքի հայտնի և հնարավոր ռիսկերը:
Որոշելով, թե արդյոք արտադրանքի հայտնի և հնարավոր օգուտները գերակշռում են հայտնի և հնարավոր ռիսկերին, FDA-ն մտադիր է նայել գիտական ապացույցների ամբողջության մեջ ռիսկ-օգուտ ընդհանուր որոշում կայացնելու համար: Այնպիսի ապացույցներ, որոնք կարող էր առաջանալ տարբեր աղբյուրներից, կարող է ներառել (բայց չի սահմանափակվում դրանով). ներքին և արտասահմանյան կլինիկական փորձարկումների արդյունքներ, in vivo արդյունավետության տվյալներ կենդանիների մոդելներից և in vitro տվյալներ, հասանելի է FDA-ի դիտարկման համար. FDA-ն նաև կգնահատի արտադրանքի որակն ու քանակը առկա ապացույցներ, հաշվի առնելով գիտական գիտելիքների ներկա վիճակը։
[BOLDFACE ԱՎԵԼԱՑՎԱԾ]
ԻՐԱՎԱԿԱՆ ԾԱՆՈԹՈՒԹՅՈՒՆ. Չկա իրավական չափանիշ և չկան իրավական սահմանումներ, թե ինչ է նշանակում «հայտնի և պոտենցիալ օգուտները» գերազանցել «հայտնի և հնարավոր ռիսկերին»: Չկա նաև որակական կամ քանակական իրավական սահմանում, թե որն է ընդունելի «հասանելի ապացույց», որի վրա «կարող է հիմնվել» ռիսկ-օգուտ վերլուծությունը: Կարող է լինել զրոյական փաստացի ապացույց, բայց համոզմունք, որ ապրանքն ունի մեծ պոտենցիալ օգուտ և ոչ մեծ պոտենցիալ ռիսկ, և դա կբավարարի այս «կանոնադրական պահանջը»:
- Այլընտրանք չկա
Որպեսզի FDA-ն թողարկի EUA, չպետք է լինի համապատասխան, հաստատված և հասանելի այլընտրանք թեկնածու արտադրանքին հիվանդության կամ վիճակի ախտորոշման, կանխարգելման կամ բուժման համար: Պոտենցիալ այլընտրանքային արտադրանքը կարող է համարվել «անհասանելի», եթե հաստատված այլընտրանքի բավարար պաշարներ չկան՝ արտակարգ իրավիճակները լիովին բավարարելու համար:
ԻՐԱՎԱԿԱՆ ՀԱՐՑ. Բացի Covid-19-ի այլընտրանքային բուժումների աղաղակող և պոտենցիալ հանցավոր զրպարտությունից/օրենքից հանելուց, ինչպիսիք են իվերմեկտինը և հիդրօքսիքլորոքինը, ո՞ր կետում կար հաստատված այլընտրանք «Covid-19»-ի կանխարգելման համար (միակ բանը, ինչի համար գնվել են mRNA պատվաստանյութերը: Օրինակ, Paxlovid-ը, որն այլևս օրինական չի դարձնի mRNA պատվաստանյութերի EUA-ն:
Ահա թե ինչպես են այս բոլոր «կանոնադրական չափանիշները» բավարարվել իրականում Արտակարգ իրավիճակների օգտագործման թույլտվություն BioNTEch/Pfizer Covid mRNA պատվաստանյութերի համար:
Ես եկել եմ այն եզրակացության, որ Pfizer-BioNTech COVID-19 պատվաստանյութի շտապ օգտագործումը COVID-19-ի կանխարգելման համար, երբ այն կիրառվում է, ինչպես նկարագրված է Թույլտվության շրջանակում (Բաժին II) համապատասխանում է 564(գ) բաժնի համաձայն թույլտվություն տրամադրելու չափանիշներին: օրենքը, քանի որ.
- SARS-CoV-2-ը կարող է լուրջ կամ կյանքին սպառնացող հիվանդություն կամ վիճակ, ներառյալ ծանր շնչառական հիվանդություն, այս վիրուսով վարակված մարդկանց առաջացնել.
- Հիմնվելով FDA-ին հասանելի գիտական ապացույցների ամբողջության վրա՝ ողջամիտ է ենթադրել, որ Pfizer-BioNTech COVID-19 պատվաստանյութը կարող է արդյունավետ լինել COVID-19-ի կանխարգելման համարև, երբ օգտագործվում է սույն թույլտվության մեջ նկարագրված պայմաններով, Pfizer-BioNTech COVID-19 պատվաստանյութի հայտնի և հնարավոր օգուտները երբ օգտագործվում է COVID-19-ը կանխելու համար գերակշռել դրա հայտնի և հնարավոր ռիսկերը. և
- Pfizer-BioNTech COVID-19 պատվաստանյութի շտապ օգտագործման համար համապատասխան, հաստատված և հասանելի այլընտրանք չկա։ COVID-19-ի կանխարգելման համար.
[BOLDFACE ԱՎԵԼԱՑՎԱԾ]
ԾԱՆՈԹՈՒԹՅՈՒՆ. Միակ համատեքստը, որում FDA-ն կշռել է պատվաստանյութի հնարավոր օգուտներն ու ռիսկերը, և որտեղ FDA-ն որոշել է, որ այն «կարող է արդյունավետ լինել», եղել է. Covid-19-ի կանխարգելման գործում.
Չկա որևէ նկատառում, փաստացի կամ պոտենցիալ օգուտի ապացույց և որոշում, որ պատվաստանյութը կարող է որևէ այլ բան անելու որևէ պոտենցիալ արդյունավետություն, ներառյալ՝ նվազեցնել ծանր հիվանդության ռիսկը, նվազեցնել հոսպիտալացման ռիսկը, նվազեցնել մահվան ռիսկը: , նվազեցնելով Covid-19-ի հետ փաստացի կամ պոտենցիալ առնչվող որևէ պայմանի վտանգը:
Հետևաբար, կարելի է ողջամտորեն կասկածի տակ առնել ցանկացած պնդումների օրինականությունը, որ պատվաստանյութը «անվտանգ և արդյունավետ» է այլ բանի համատեքստում, քան «երբ օգտագործվում է COVID-19-ի կանխարգելման համար», ինչը հայտնի էր, որ պատվաստանյութերը ՉԵՆ ԱՆԵԼ շատ շուտով: ներկայացրել է.
Եթե մարդկանց ասեին, որ BioNTech/Pfizer mRNA պատվաստանյութերը «անվտանգ և արդյունավետ» են այլ կերպ, քան Covid-19-ը կանխելու համար, և եթե նրանց սպառնան որևէ հետևանք՝ պատվաստանյութը չընդունելու համար, բացի Covid-19-ի կանխարգելումից, կարո՞ղ են նրանք: ունե՞ք օրինական փաստարկ այն մասին, որ նրանք անօրինական կերպով ստիպել են վերցնել չհաստատված ապրանքը խարդախ պահանջներով:
Երրորդ մակարդակի պահանջներ EUA-ի համար չհաստատված ապրանքների համար
Երբ մենք ունենք ԵՄԱ-ի հատուկ արտակարգ իրավիճակների հայտարարությունը, և երբ FDA-ն հայտարարում է, որ արտադրանքը կարող է արդյունավետ լինել, և որ առկա ապացույցները (զրոյից մինչև անսահման) ցույց են տալիս, որ դրա օգուտները գերազանցում են ռիսկերը (ինչպես որոշվում է FDA-ի կարծիքով՝ դրանք կարող են լինել: լինի), գոյություն ունի ոչ անվտանգ, ոչ արդյունավետ կարգավորման ևս մեկ շերտ:
Ահա թե ինչպես ա 2018 Կոնգրեսի հետազոտական ծառայության զեկույց ԵՄԱ-ի վերաբերյալ բացատրում է սա.
FFDCA §564-ը հրահանգում է FDA-ին սահմանել որոշակի պահանջվող պայմաններ EUA-ում և թույլատրում է լրացուցիչ հայեցողական պայմաններ, որտեղ անհրաժեշտ է: Պահանջվող պայմանները տարբերվում են՝ կախված այն բանից, թե արդյոք EUA-ն նախատեսված է չհաստատված արտադրանքի համար, թե հաստատված արտադրանքի չհաստատված օգտագործման համար: Չհաստատված արտադրանքի համար օգտագործման պայմանները պետք է.
(1) ապահովել, որ արտադրանքը տնօրինող առողջապահական մասնագետները ստանան անհրաժեշտ տեղեկատվություն.
(2) ապահովել, որ անհատները, որոնց տրամադրվում է արտադրանքը, ստանան պահանջվող տեղեկատվությունը.
3) ապահովում է արտադրանքի հետ կապված անբարենպաստ իրադարձությունների մոնիտորինգ և հաղորդում. և
4) ապահովում է արտադրողի կողմից հաշվառման և հաշվետվությունների պահպանում:
ԻՐԱՎԱԿԱՆ ՀԱՐՑ. Կոնկրետ ո՞րն է «պահանջվող տեղեկատվությունը»: Մենք գիտենք, որ մարդիկ տեղեկացվել են, որ պատվաստանյութերին տրվել է Արտակարգ իրավիճակների օգտագործման թույլտվություն: Բայց արդյո՞ք նրանց ասվել է, որ դա նշանակում է «ապացույցների ավելի ցածր մակարդակ», քան պահանջվում է այլ բժշկական արտադրանքի վերաբերյալ «անվտանգ և արդյունավետ» պահանջների համար: Արդյո՞ք նրանք տեղեկացված են, որ կան «անվտանգ և արդյունավետ» տարբեր մակարդակներ՝ կախված նրանից, թե արտադրանքն ունի EUA կամ այլ տեսակի թույլտվություն:
ԾԱՆՈԹՈՒԹՅՈՒՆ. Օրենքը պահանջում է, որ լինի անբարենպաստ իրադարձությունների մոնիտորինգի և հաղորդման միջոց: Այնուհանդերձ, այնտեղ չի նշվում, թե ով է մշտադիտարկում, ինչ չափորոշիչներով է ներկայացվում հաշվետվությունները և ինչ շեմ է նախատեսված հաշվետվությունների հիման վրա գործողություններ ձեռնարկելու համար:
EUA Համեմատած ցանկացած այլ դեղամիջոցի/պատվաստանյութի հաստատման ուղու հետ
Որպես հետազոտող/գրող Սաշա Լատիպովա նշել է, որ շատերը շփոթված էին EUA-ի կողմից, քանի որ այն շատ նման է EAU-ին, որը նշանակում է «Expanded Access Use»: Սա թույլտվության տեսակ է, որը տրվում է բժշկական արտադրանքին, երբ հրատապ կարիք կա հիվանդների որոշակի խմբի կողմից (օրինակ՝ IV աստիճանի քաղցկեղով հիվանդներ, որոնց կյանքի տեւողությունը չափվում է ամիսներով), ովքեր պատրաստ են ռիսկի ենթարկել անբարենպաստ իրադարձություններ և նույնիսկ մահ՝ հասանելիության դիմաց։ փորձարարական բուժման համար:
Արտակարգ իրավիճակների օգտագործման թույլտվությունը ոչ մի կերպ կապված չէ և ոչ էլ նմանություն ունի Ընդլայնված մուտքի օգտագործման հետ:
Բժշկական արտադրանքի թույլտվության տարբեր իրավական ուղիները հստակ ներկայացված են իրավական հետազոտողի կողմից ընդգծված աղյուսակում Քեթրին Ուոթ. Աղյուսակը FDA-CDC համատեղ ուսումնական նստաշրջանի 2020 թվականի շնորհանդեսի մի մասն է. Բժշկական հակազդեցությունների կիրառման կանոնակարգային թարմացումներ.
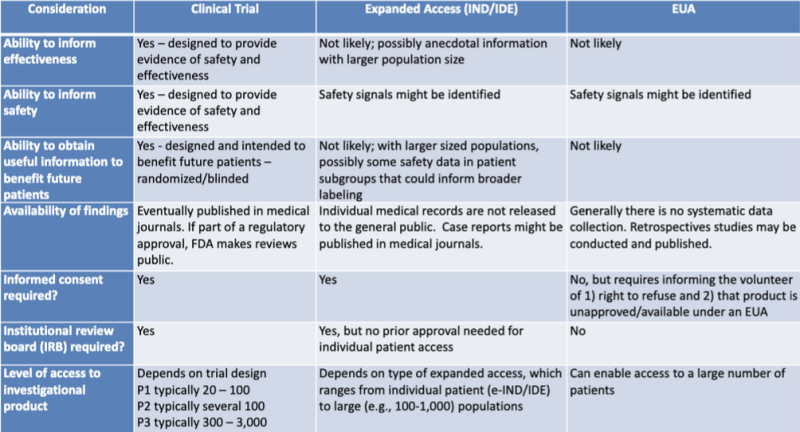
Այս աղյուսակը շատ հստակ ցույց է տալիս, որ EUA գործընթացը հազիվ թե տեղեկատվություն տրամադրի արտադրանքի արդյունավետության վերաբերյալ, նախատեսված չէ անվտանգության ապացույցներ ապահովելու համար, հավանական չէ, որ օգտակար տեղեկատվություն տրամադրի ապագա հիվանդներին, չի ներառում տվյալների համակարգված հավաքագրում, չի պահանջում հետահայաց ուսումնասիրություններ, ոչ տեղեկացված համաձայնություն և ոչ ինստիտուցիոնալ վերանայման խորհուրդ:
Ավելին, Ա 2009 Ազգային ակադեմիական բժշկության ինստիտուտի հրատարակություն, որը նաև ընդգծեց Ուոթը, վերնագրված «Բժշկական հակաքայլեր. Արտակարգ իրավիճակների օգտագործման թույլտվություն և փոստային մոդել – սեմինարի ամփոփում» վերնագրով մենք գտնում ենք այս հայտարարությունը p. 28:
Կարևոր է գիտակցել, որ ԵՄԱ-ն զարգացման ուղու մաս չէ. այն ամբողջովին առանձին միավոր է, որն օգտագործվում է միայն արտակարգ իրավիճակների ժամանակ և դեղի հաստատման գործընթացի մաս չէ:
Արդյո՞ք սա նշանակում է, որ Covid-19-ի հակաքայլերի հաստատումները, որոնք հիմնված էին EUA-ների վրա, անօրինական էին: Արդյո՞ք դա նշանակում է, որ չկա օրինական ճանապարհ՝ պնդելու, որ EUA արտադրանքը «անվտանգ և արդյունավետ» է, քանի որ այն ԴԵՂԵՐԻ ՀԱՍՏԱՏՄԱՆ ԳՈՐԾԸՆԹԱՑԻ ՄԱՍ ՉԷ:
Եզրափակում
Դա ակնհայտորեն ակնհայտ է, հաշվի առնելով այս հոդվածի և նախորդի բոլոր տեղեկությունները Part 1, որ BioNTach/Pfizer Covid mRNA պատվաստանյութերը մշակվել, արտադրվել և լիազորված են ռազմական օրենքներով, որոնք վերապահված են արտակարգ իրավիճակների համար, որոնք ներառում են կենսաբանական պատերազմ/ահաբեկչություն, այլ ոչ թե բնականորեն առաջացող հիվանդություններ, որոնք ազդում են ողջ քաղաքացիական բնակչության վրա:
Հետևաբար, կանոնակարգերի և վերահսկողության պահպանումը, որը մենք ակնկալում ենք գտնել, երբ արտադրանքը համարվում է «անվտանգ և արդյունավետ» ողջ քաղաքացիական բնակչության համար, օրինականորեն պարտադիր չէր:
Արդյո՞ք այս վերլուծությունը կարող է օգտագործվել՝ վիճարկելու այն պետական պաշտոնյաների «անվտանգ և արդյունավետ» պահանջի օրինականությունը, ովքեր գիտեին, թե ինչ է ենթադրում ԵՄԱ-ն: Կա՞ն այլ իրավական հետևանքներ:
Հույս ունեմ.
Կարևոր է, որ մինչ այժմ Covid mRNA պատվաստանյութերի դեմ ներկայացված իրավական մարտահրավերներում չկան որոշումներ (որին ես տեղյակ եմ), թե արդյոք ռազմական օրենքը, ինչպես OTA-ն և EUA-ն, կարող են կիրառվել քաղաքացիական իրավիճակներում: Այնուամենայնիվ, եղել է Շրջանային դատարանի դատավոր Մայքլ Թրունքեյլի հայտարարությունն իր մեջ ազդարարի գործի կարճում Բրուկ Ջեքսոնն ընդդեմ Ventavia-ի և Pfizer-ի, դա կարևոր է հիշել:
Այստեղ դատավորը ընդունում է, որ BioNTech/Pfizer mRNA պատվաստանյութերի համար պայմանագիրը ռազմական OTA էր, սակայն նա հրաժարվում է որոշում կայացնել դրա կիրառելիության մասին ոչ ռազմական հանգամանքներում (բնական հիվանդություն, 100 միլիոն չափաբաժիններ հիմնականում ոչ ռազմական օգտագործման համար), որոնց դեպքում այն կիրառելի է։ թողարկվել է՝
Այն փաստը, որ թե՛ զինվորականները, թե՛ քաղաքացիական անձինք ստացել են պատվաստանյութը, չի նշանակում, որ պատվաստանյութի ձեռքբերումը կապ չունի բանակի առաքելության արդյունավետության բարձրացման հետ: Ավելի կարևոր է, որ տիկին Ջեքսոնը փաստորեն խնդրում է այս դատարանին չեղարկել Պֆիզերի պատվաստանյութը ձեռք բերելու համար Գործարքների այլ լիազոր մարմնի գործադրման վերաբերյալ DoD-ի որոշումը: Բայց ինչպես Միացյալ Նահանգների Գերագույն դատարանը վաղուց է ընդգծել, «զինվորական ուժերի կազմի, վերապատրաստման, սարքավորման և վերահսկման վերաբերյալ բարդ, նուրբ և մասնագիտական որոշումները, ըստ էության, պրոֆեսիոնալ ռազմական դատողություններ են»: Գիլիգանն ընդդեմ Մորգանի, 413 ԱՄՆ 1, 10 (1973): Այսպիսով, «դժվար է պատկերացնել պետական գործունեության մի ոլորտ, որտեղ դատարաններն ավելի քիչ իրավասություններ ունեն»։ ID. Այս դատարանը վետո չի դնի ազգային արտակարգ իրավիճակների ժամանակ առաքելության արդյունավետության վերաբերյալ ՀՀ պաշտպանության վճիռների վրա:
Սա ընդամենը մեկն է բազմաթիվ իրավական խոչընդոտներից, որոնք մնում են «Covid-19»-ի արտակարգ իրավիճակների ժամանակ հաստատված բոլոր mRNA արտադրանքները, և ցանկացած հետագա mRNA արտադրանք, որի հաստատումը հիմնված է Covid-19-ի հաստատման գործընթացի վրա, ի վերջո օրենքից դուրս հանելու պայքարում:
Հրատարակված է Ա Creative Commons Attribution 4.0 միջազգային լիցենզիա
Վերատպումների համար խնդրում ենք կանոնական հղումը վերադարձնել բնօրինակին Բրաունսթոունի ինստիտուտ Հոդված և հեղինակ.









